今日は本実験の染色をする過程とその注意点についてお話します。原則、臨床検査技師の方・血液内科医師・医生物学的な研究をする研究者を、想定聴衆として書きます。皆様に役に立つ内容ではないものの、日本語での情報は不十分だと感じてます。今後の日本発のサイトメトリーの臨床・研究のスタンダードが上がることを祈念しながら、医学者ナカノが解説していきます
本日の結論:
- フローサイトメトリーの染色の過程について順を追って説明します
- 染色する細胞数・蛍光抗体を染色する時の容積あたりの割合を揃えることは重要です
- 抗原提示細胞のFc Blockingは染色品質向上にオススメです
- 2色以上のポリマー色素を使用する場合には専用のBufferを使うべきです
- 重染色はカクテルを作成して行うことをオススメします
- 染色と測定を別日で行う場合固定した方が良い場合もあります
染色から測定までの手順は通常、
最終的に1 x 106cellsなどFACS tubeに一定数の細胞を
アミン系はBSA/FBS抜きのPBSでWash後、重染色前に染色が推奨されています
アミン染色後2回FACS bufferでWashする
不適切な蛍光色素の標識を防ぐために重要です
5~10%多めに作成することをおすすめします
死細胞染色が同時に染色できるかは個別に検討が必要です
染色時間は通常30~60分程度です
低温で活性化する細胞でなければ冷暗所(冷蔵庫)で行います
ビーズの染色時間は20分程度が多いです
FACS buffer 1~2mLを加えて遠心分離します
固定は1%PFA(パラホルムアルデヒド)などで行いますが
細胞内染色のキットに含まれている場合もあります
サイトメーターに合わせて適切な懸濁量を見つけてください
複雑な実験の場合、別日に予め実験のプロトコールを設定しておくと当日スムーズです
Step1:細胞数を計測してそろえることは、かなり重要です
例えばCD15を染色する時にPBMC106個と、顆粒球だけ106個で約10倍蛍光強度が違ったことがありました。抗原が飽和している状態だと本来PositiveになるべきPopulationがDimになってしまいます。ひとによって白血球分画は異なるので毎回完全に一緒にすることは不可能なのは間違いないのですが、細胞数を数えて揃える程度のことは簡単なのでオススメいたします
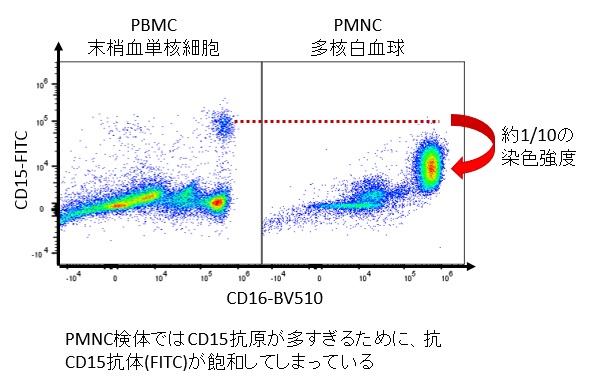
抗体の使用量はIncubation VolumeあたりX mLというのは、Titrationのうえ毎回完全に一緒にするべきです。ロットが新しくなるたびにTitrationしなおしているひともいるくらいです(3Dナカノはそこまで神経質にはやってません)
Step2:アミン系死細胞染色
LIVE/DEADやZombieなどのアミン系の死細胞染色色素は、アミノ酸残基を染色するものなのでBSA/FBSが存在すると染色の効率が下がることが理解できると思います。面倒ですがPBSでWashして、PBSで溶いたアミン系の染色試薬で染色するのが基本のやり方です。Step4のカクテルにアミン系染色色素を混ぜる猛者もいますが、結果が変わらないか予備実験をオススメします

Step3:FcBlocking・Brilliant Stain Buffer
FcBlockingは、
単球やB cellや樹状細胞などの表面のFc Receptorを介して抗体が接着するのを防ぐ方法で、
蛍光抗体で染色する前に添加する必要があり、重染色前にBrilliant Staining Bufferと同時に添加します
ポリマー色素を複数使用する場合には、
ポリマー色素同士が結合しやすいという性格を持つので、
蛍光抗体添加前にBrilliant Staining Bufferに類する試薬を使用する必要があります

Step4:重染色用のカクテルを作成
- FACS bufferと各種蛍光抗体を混ぜたものです
- 染色を均一に行うのと、染色忘れを防ぐ意味でカクテルを作成することは重要です
- 必要な量の5~10%増し程度で作って不足が出ないようにします
- Titration結果の順番に抗体を並べておくと添加する抗体の量の混乱が減らせると思います
- FMO controlを作るときはこの時点で同時並行で染色します(抜く色だけ先に染色すると忘れにくい)
3Dナカノは面倒ではありますが毎回実験前に混ぜる量を計算してフレッシュなカクテルを作っています。ちょっとした工夫として、Titration結果の順番に抗体を並べてあるので、混ぜる量を間違えないというのはやってみてもいいことかもしれません
- 蛍光抗体は全部混ぜた状態で保存して使えませんか?
-
原則推奨されません。特にタンデム色素はややこしくなるのでやめたほうが良いです
- 単染色の(コンペンセーション)コントロールは毎回作る必要がありますか?
-
タンデム色素の乖離率が違うので毎回測定するのが最善です。特にスペクトラルサイトメーターでは致命的です
タンデム色素に関して詳しくは以下の記事をご覧ください

Step7:Wash
- Washが2回なのはシグナルとノイズの分離によいとされるからです
- 遠心分離の度に細胞が僅かずつ失われるので、そこはトレードオフの関係にあります
Step8:細胞を固定する場合、
- 固定後、細胞内染色するためのキットを使用したり、
- 1%パラフォルムアルデヒド(PFA)・PBSを調製します
- 固定前後の蛍光特性の変化の確認は、最低限一回必要です
- 加えて別日にサイトメーターで測定する場合時系列の変化の確認は、最低限一回必要です
細胞内染色のキットにはサポニンなど細胞に空いた穴が開いた状態を維持して、適切な染色条件を維持できるような物質が添加されています。蛍光抗体をWashする過程もしっかりとその状態が維持されていないと洗えないので、プロトコールをよく読んで正しく対処してください
PFAはホルマリンの前駆体で、16%PFAとPBSを1:15で希釈することで例えば1%PFA・PBSを準備します。PFAのバイアルを開けてすぐに希釈したてのものを、10-15分すべての重染色・コントロールに添加して、2回以上Wash(PFAで脱水されているので加水)することが推奨されています。「蕎麦の三たて」に似た精神を感じます。PFA濃度や作用時間は比較的よく使われるものを示していますが、検査や実験の条件次第で濃淡・長短の最適化をオススメします
PFAの添加はタンデム色素を安定化する作用が期待される一方で、色素の褪色のリスクもあるので、必ず単染色と重染色のサンプル全てで同じ操作(PFA・Washなど)を行う必要があります
3Dナカノは臨床検体でサンプルの準備と染色に7時間ぐらいかかって、サイトメーターでの測定に6時間くらいかかる実験をしていました。固定して2日に分けられたのは体力的にも精神的にも助かりました
Step9:染色した細胞を懸濁して測定するときの考慮すべき点は、
- ポリプロピレンとポリスチレンのどちらのチューブを使うか、
- 懸濁に使うバッファーに何を用いるか、
- セルストレイナーを用いるかどうかなどです
検体を懸濁して測定するまでの注意点に関して詳しくは以下の記事をご覧ください

まとめ:
本日の染色に関する過程の記事はいかがだったでしょうか。今までの記事で説明している部分と重複している内容が多いですが、もしよかったら過去の記事もご参照ください。読んでも不明な点は質問をお寄せください。自信を持って正しい結果を出せるように頑張っていきましょう!






コメント