フローサイトメトリーのパネル設計方法を詳しく解説します。原則、臨床検査技師の方・血液内科医師・医生物学的な研究をする研究者を、想定聴衆として書きます。皆様に役に立つ内容ではないものの、日本語での情報は不十分だと感じてます。今後の日本発のサイトメトリーの臨床・研究のスタンダードが上がることを祈念しながら、医学者ナカノが解説していきます
本日の結論:
- パネルの設計に重要なのは、
- 絶対に測定したい抗原・典型的な表面抗原・オマケの3つに分けることです
- 販売されていてサイトメーターで使える蛍光色素の組み合わせをリストアップして、
- 絶対に測定したい抗原をSIが大きい蛍光色素から順番に割り当てます
- 典型的な表面抗原はなるべくSIが小さい暗い蛍光色素を割り当てます
- ダンプチャンネル・標的細胞染色・死細胞染色も検討をオススメします
- 上手な人のパネルを真似するのもとてもオススメです
言葉の解説をします、
パネルを設計する際に重要なのは、
- 絶対に測定したい実験的に重要な抗原(細胞表面・細胞内)
- 測定したい典型的な細胞表面抗原測定
- できると今後の展開が楽しみなオマケの抗原
を確認して、売られている蛍光色素をリストアップすることです
絶対に正確に測定したい実験的に重要な抗原は、
一番Staining indexが大きくほかのチャンネルから漏れこまれにくい色素を使う場合が多いです
CCR/CXCR(ケモカインレセプター)はStaining indexが大きいものがよい傾向があります
典型的にはPE, APC, (FITC), BB515, BV412, BUV395, BV650, PE-Cy7などがつかわれます
抗体単体で発売後、Staining index(SI)が大きい色素から順番に発売されることが多いです
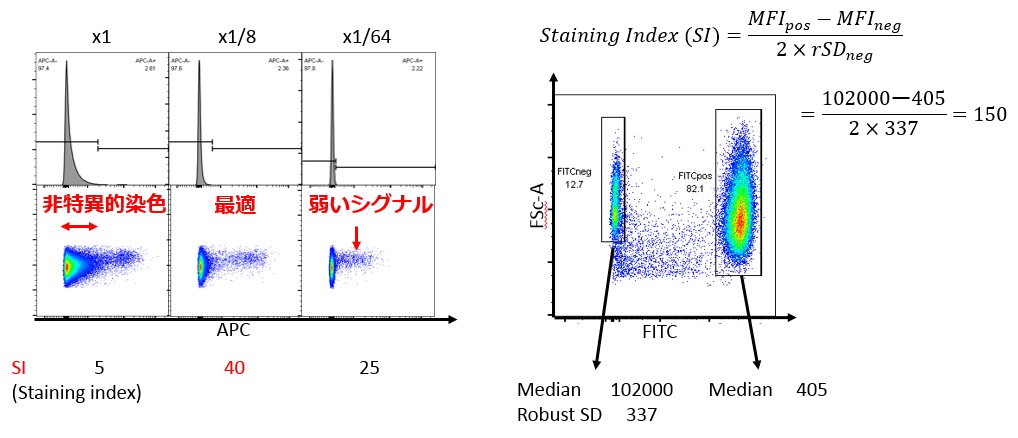
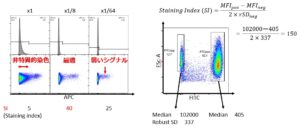
Staining indexは、
- 陽性集団と陰性集団の差と、陰性集団の非特異的染色を加味した指数です
- いわゆる蛍光色素の明るさに該当する値で、サイトメーター毎に固有です
- 他のサイトメーターのSIは大体似た傾向になりますが数値は異なります
Staining indexの計算方法に関して詳しくは以下の記事をご覧ください
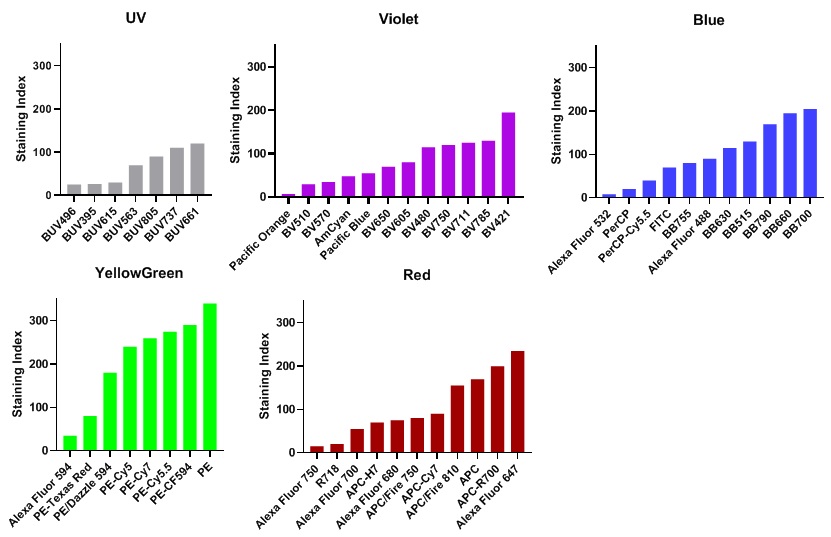
各レーザーのSIの順位は、
下の図のとおりです。Yellow Green LaserがSI的には良いのですが、自家蛍光・他のレーザーからの漏れ込みなどを勘案すると絶対に測定したい実験的に重要な抗原は少し配置しづらいのが現状です。逆にBUV395はSIが小さいのですが、漏れ込まれる可能性がほぼないので、重要な抗原を配置する場合があります
測定したい典型的な細胞表面抗原は、
- 細胞表面のCD3, 4, 8, 14, 15, 16, 19, 20, 56などが該当します
- 陽性と陰性がはっきりしているので、暗い(SI が小さい)蛍光色素を選択するのが良いです
SIが小さい蛍光色素は例えば、BUV395, BUV496, BV510, BV570, V450, V500, Pacific Blue, Pacific Orange, FITC, PerCP, AlexaFluor488, AlexaFluor594, AlexaFluor700, AlexaFluor750, APC-H7などです
暗い蛍光色素を選択するのが良いのは、
- 細胞表面に多く存在する抗原が明るすぎると、
- 微細な抗原の標識に漏れこむ恐れがあることと、
- 暗い蛍光色素でも十分に分離が可能であることが多いためです
なお、「human antigen density chart」などと検索すると抗原の多寡がある程度わかりますので、見てみてください
漏れこみが起きやすい近隣のチャンネルは、
なるべく共発現していない抗原を選ぶほうが良いです
- 悪い例:CD4-BV605・CD3-BV650・CD8-BV711
CD4+T cellはBV605とBV650 CD8+T cellはBV650とBV711
が陽性になって、近いチャンネル同士漏れこみが起きる (データに広がりが出る)
- 良い例:CD14-BV605・CD3-BV650・CD15-BV711
CD14は単球・CD3はT cell・CD15は好中球で主に発現しているので、
重染色の検体では漏れこみはほぼ発生しなくなります
細胞表面のマーカーの共発現は抗体販売会社のウェブサイトなどで確認するといいと思います
ダンプチャンネルは、
- 解析対象としない細胞は全部同じ蛍光色素(PECy7など)で標識して、
- 解析対象外にする操作です
例えばB細胞のみ解析したい場合、CD3, 14, 16, 死細胞をAPC-Cy7やLIVE/DEAD Fixable Stain NIRで染色して解析から除外する例を示します(OMIP-047)
標的細胞の染色は、
例えばヒト白血球ならCD45陽性であるものが解析対象になることが多いですし、
例えばGFPなどの蛍光蛋白で標識した細胞のみが解析対象になることもあります
これらもパネル設計の段階で予めどの程度他の標識に漏れこんで大丈夫か、考える必要があります
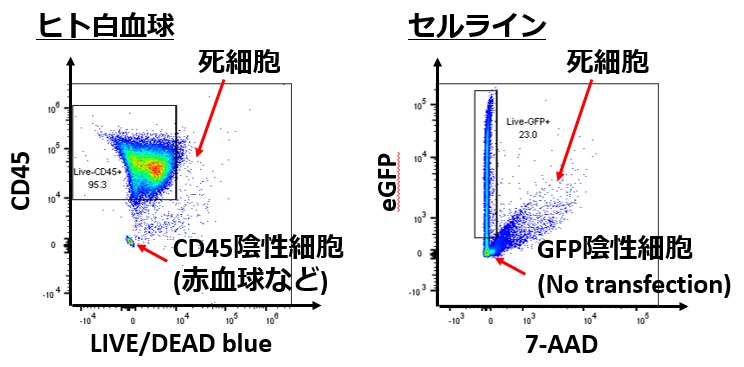
死細胞は、
- 蛍光抗体を非特異的に吸着する性質があるので、
- 現代のフローサイトメトリーの実験では除去することが重要です
詳しくは以下の記事で解説していますのでご覧ください

パネルの設計の見本は、
- Cytometry A誌に掲載されているOMIPがとても参考になると思います
- Optimized Multicolor Immunofluorescence Panels
- Cytometry A誌はサイトメトリー専門誌で、
- OMIPは専門家が設計した上手なパネル設計の見本市です
サイトメーター毎にフィルターやレーザーが異なるので必ずしも援用できるわけではないですが、設計の基本方針は参考になるはずです。昔の機器で使えるパネルは初期のOMIPをみるとよいと思います
2010年代の8色のパネルを組み合わせによって、40以上のヒト白血球を標識したパネルも参考になるかもしれないのでご紹介します

まとめ:
さて、本日のパネル設計に関するお話はいかがだったでしょうか。3Dナカノはフローサイトメーターの中央部門のひとにパネルを見てもらったり、サイトメーター販売会社(BD, Cytek)の担当のひとにパネルを見てもらったりしました。上手な人に意見を聞いてみることをオススメしたいと思います。読んでも不明な点は質問をお寄せください。自信を持って正しい結果を出せるように頑張っていきましょう!







コメント