死細胞の除去が必要な理由・方法について解説します。原則、臨床検査技師の方・血液内科医師・医生物学的な研究をする研究者を、想定聴衆として書きます。皆様に役に立つ内容ではないものの、日本語での情報は不十分だと感じてます。今後の日本発のサイトメトリーの臨床・研究のスタンダードが上がることを祈念しながら、医学者ナカノが解説していきます
本日の結論:
- 死んだ細胞は、非特異的に蛍光抗体を吸着し、偽陽性となります
- 死んだ細胞をしっかり染色して除去することをオススメします
- 多重染色する場合にはアミン染色が便利ですが、注意点がいくつかあります
- アミン染色をする場合は、BSA/FBSの要否・長期冷凍保存・ビーズでのCompensation controlの予備実験をすることをオススメします
死んだ細胞は、
- 非特異的に蛍光抗体を吸着します (偽陽性が増える)
- しっかり染色して除去しましょう
- デブリやフルイディクスの詰まりの原因にもなります
死んだ細胞は細胞表面の膜構造が破綻しているなどの理由で、抗体のFab部分による特異的な結合ではない形で蛍光色素で標識されます。それらは通常測定したい対象ではないので、死んでしまった細胞は標識して解析対象外にします
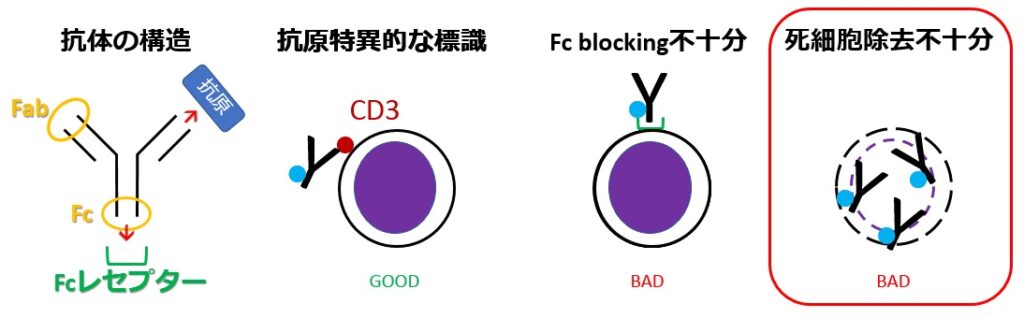
死細胞を減らすためにできることは、
- 1~2%のFBS(牛胎児血清), BSA(牛血清アルブミン)を添加した培地を使用する
- HEPESを使用してPCO2(二酸化炭素分圧)が低い状況でも酸塩基平衡を保つ
- 検体を低温に保つ (代謝を落とす・但し好中球は低温で活性化/死ぬとされている)
- 細胞の回収にセルスクレーパーを使用しない
- 生細胞をエンリッチするキットを使う(MACSやEasysepなど)
死細胞を染色する方法は2通りあって、
- 古典的な色素:2本鎖DNAに結合するもの
- 新しい色素:アミン色素
に分かれています
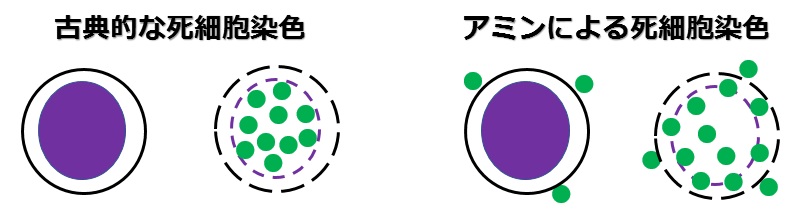
古典的な色素は、
- 青(488nm)・黄緑(561nm)のレーザーで検出されるものは:7-AAD・PIなど
- 紫(405nm)・UV(355nm)のレーザーで検出されるものは:DAPIなど
の2通りがあります
PI (Propidium iodide)はフルイディクスを汚染するのであまり使われていません
7-AAD (7-Aminoactinomycin D)はPE/Cy5・PE-CF594などと蛍光特性が近く、コンペンセーションが難しくなることと、蛍光強度が比較的弱いためやや使いにくいです
DAPIはUV laserで本来の励起がされる色素ですが、Violet laserでも励起されて明るく観測される色素です。Emissionが600nm付近まであるので多重染色する場合にコンペンセーションが難しくなりがちで、最適解じゃなくなる場合があります
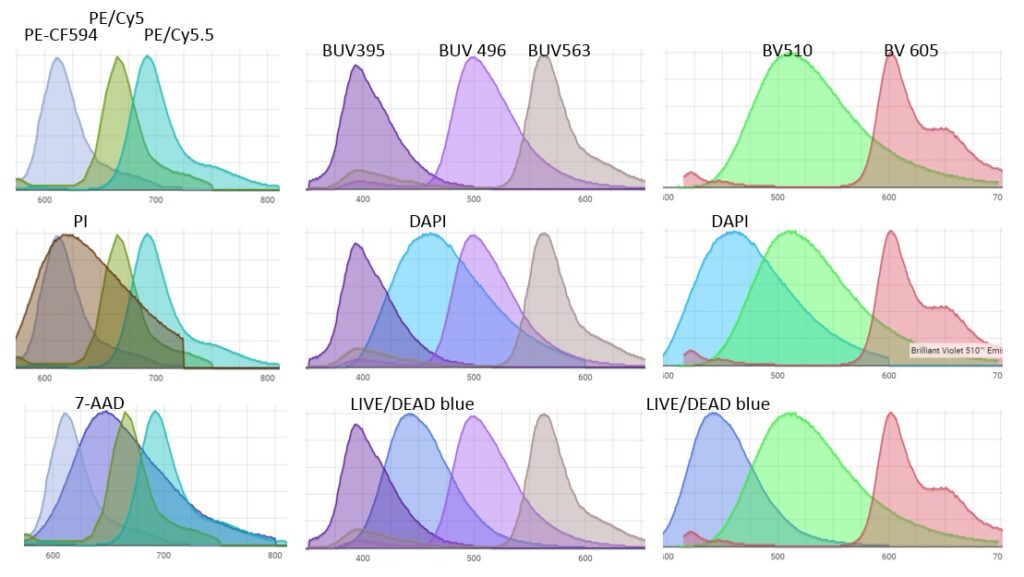
(中) BUV496への漏れ込みはLIVE/DEAD blueの方がDAPIよりかなりマイルド
(右) BV510への漏れ込みはLIVE/DEAD blueの方がDAPIよりかなりマイルド
新しい死細胞染色の色素は、
- アミン(蛋白質)を染色するものです
利点は非常に多様な製品が発売されているのでどのパネルでも採用しやすいことです
欠点はアルブミンや、血清を含む培養液中での染色が推奨されない(工程が多い)ことと
溶解後に、比較的短時間で使い切らないといけない場合が多いことです
アミン染色とは、
- 穴が開いた死細胞の中のアミンを染色します
- Biolegend社とThermoFisher社から発売されているものがしばしば使われます
- 幅広いチャンネルに対応しているので使いやすいです
アミンは細胞内に豊富に存在するので、膜構造が破綻した死細胞は強く染色されます。アミン染色をしてから固定すると、全部の細胞が最終的に死んでいることには違いがないのですが、固定前の時点で生きていた細胞は標識を免れます(この特性自体はDNAに結合する古典的な色素でも同じです)。Biolegend社のアミン染色は、そういう理由で「Zombie」という製品名がつけられています。ThermoFisher社から発売されているLIVE/DEAD Fixable Stainは以下の表のようにZombieよりさらに幅広いチャンネルに対応しています
| LIVE/DEAD (ThermoFisher社) | Zombie (Biolegend社) | Laser | Compatible channel |
| Blue (350/450) | UV (361/455) | UV | DAPI |
| Violet (416/451) | Violet (400/423) | Violet | PacBlue/BV421 |
| Lime (405/506) | Violet | eFluor506/PacOrange | |
| Aqua (367/526) | Aqua (382/510) | Violet | AmCyan/BV510 |
| Yellow (400/575) | Yellow (396/573) | Violet | Qdot605/BV605 |
| Green (495/520) | Green (491/516) | Blue | FITC/AF488/GFP |
| Olive (480/557) | Blue | FITC/AF488/GFP | |
| Orange (580/602) | YG | PE-CF594/PE-TexasRed | |
| Red (595/615) | Red (600/624) | YG | PE-CF594/PE-TexasRed |
| Far Red (650/665) | Red | APC/AF647 | |
| Scarlet (702/723) | Red | AF700/APC-Cy5.5 | |
| Near-IR775 (750/775) | Red | APC-Cy7 | |
| Near-IR780 (633/785) | Red | APC-AF750 |
かっこ内は(Excitation max/Emission max)を示しています
アミン染色は蛋白質を染色するので、
BSA(アルブミン)やFBS(牛血清)など蛋白質が含まれない培地を使用することが推奨されています
細胞染色前にPBSやRPMIでWash(遠心分離・上清破棄)して、PBSやRPMIにアミン色素を懸濁して染色することになります。BSAやFBS入りで実験したい場合、蛋白質の有無で染色が変わらないか予備実験での検討をオススメします
| LIVE/DEAD Fixable Stain | Zombie | |
| 蛍光チャンネルの選択 | 多様 (10種類) | 中等度 (6種類) |
| 凍結乾燥 | 小分け (40検体分毎) | 多め (100検体分単位) |
| 使用時期の推奨 | 溶解後-20℃で1か月以内 | 溶解後数時間以内 小分けにして-80℃(期限不明) |
アミン染色は凍結乾燥されたものを、
- DMSO(疎水性溶媒・油)で溶解して使います
- 原則溶解後すぐに使用したほうが良いですが、
- もう少し長く保存できる場合もあります (予備実験をオススメします)
Biolegend社のZombieは溶解後-20℃で1か月・ThermoFisher社のLIVE/DEAD fixable stainは溶解後数時間以内での使用が推奨されています。LIVE/DEAD fixable stainの方が少量で凍結乾燥されているものの、短期間での使用が推奨されています。実際には-20℃でもう少し長期的に保存して使われている場合があるので、実際に扱う検体での予備実験をオススメします
死細胞のCompensation Controlは、
- 古典的な色素の場合は、たくさんの細胞を染色してたくさん測定するのがオススメです
- アミン染色の場合はアミン染色用のビーズが使える場合があります
細胞を60C・10分だったり、薬品などで殺す方法もありますが、1%死細胞がいると仮定すれば50万イベントで5000個死細胞が取れるので沢山データを取る方法が本来は理想的です
アミン染色用のビーズをアミンで染色する方法も用いられます。細胞に比べて蛍光特性が安定していることと、貴重な細胞を無駄にしない利点があります。一方で細胞と自家蛍光の特性が異なるので、スペクトルサイトメーターでは細胞のほうが有利な場合もあるとされています。この場合は細胞とビーズを比較して、どちらを採用するか検討したほうがよいでしょう。3DナカノはThermo Fisher社のArC Beadsを愛用しています
オススメする予備実験は
- 死細胞染色に古典的な染色・アミン染色を使うか
- 染色する死細胞染色色素のTitration (使用推奨の1, 1/2, 1/4, 1/8, 1/16)
- アミン染色の場合はFBS/BSA抜きにする必要があるか
- アミン染色の長期保存で染色性が変わらないかどうか
- アミン染色のCompensation controlにビーズが使用可能かどうか
です。Titrationの仕方は各種FACS抗体と同じなので、別途詳しく解説します
まとめ:
さて、今回の死細胞の除去のお話はいかがだったでしょうか。3Dナカノは最初は盲点過ぎて衝撃を受けたことを覚えています。今は多くの場合アミン染色を使って、あまり苦労せずに解析対象外にすることができています。読んでも不明な点は質問をお寄せください。自信を持って正しい結果を出せるように頑張っていきましょう!








コメント