フローサイトメトリーの鬼門、コンペンセーションに必要な準備について詳細に解説します。前編ではコンペンセーションに必要な準備についてお話します。原則、臨床検査技師の方・血液内科医師・医生物学的な研究をする研究者を、想定聴衆として書きます。皆様に役に立つ内容ではないものの、日本語での情報は不十分だと感じてます。今後の日本発のサイトメトリーの臨床・研究のスタンダードが上がることを祈念しながら、医学者ナカノが解説していきます
本日の結論:
- Compensation controlとは、コンペンセーションをするための単染色のサンプルです
- N色で染める場合N通りのサンプルが必要になります
- 陽性細胞が少なすぎる場合には細胞が使えない場合があります(ビーズを使用する)
- Compensation controlは、
- 必ず細胞サンプルと同じ蛍光色素を使うこと、
- 陽性と陰性のControlをマッチさせること、
- 重染色の検体と同じかそれ以上の蛍光強度にすること、
- 十分な量のサンプルをとること、が重要です
言葉の解説をします
コンペンセーションは、
蛍光色素から発せられた光が、別の色素を検出するチャンネルに漏れこむ現象を補正する操作です
たとえば、BV605とBV650で染色したサンプルを、405nmの紫色レーザーで励起した場合での見え方をみてみましょう。単染色で陽性と陰性の細胞集団が、非染色チャンネルのすべてで中央値が等しくなるように演算される操作です
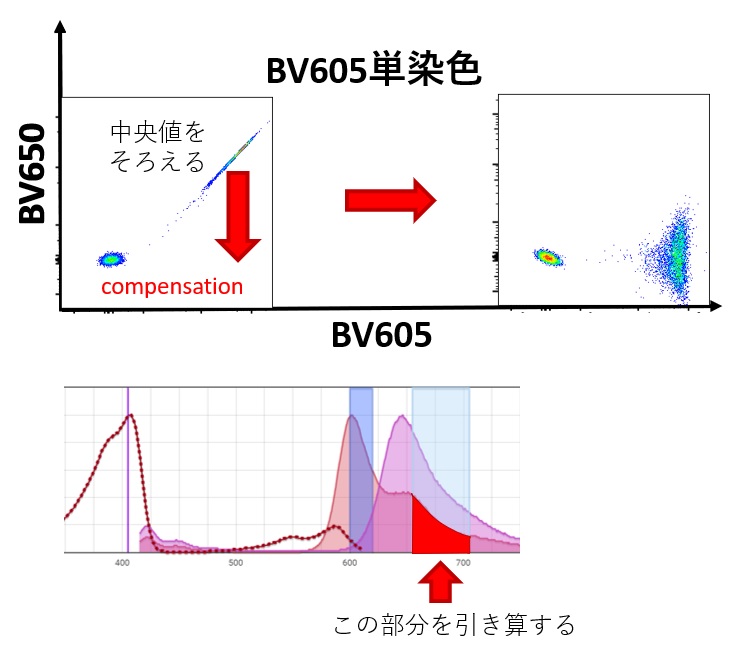
コンペンセーションが必要な理由は、
- 非特異的な蛍光を計算で除外しないと、蛍光抗体の正しい定量が出来ないからです
蛍光色素の多くは主に長波長寄りに長いEmissionを持ちます。コンペンセーションをしていない状態では、近隣の似たEmissionの蛍光抗体の漏れこみをうけて偽陽性になる傾向があります。コンペンセーションをすると、抗体固有の蛍光量を算出することが出来ます。

Compensation controlとは、
- コンペンセーションをするための単染色のサンプルです
- N色で染める場合N通りのサンプルが必要になります
- 陽性細胞が少なすぎる場合には細胞が使えない場合があります (ビーズを使用します)
- 陰性の細胞は未染色(Unstained)の細胞が使える場合があります
細胞を使うと背景の自家蛍光も揃えられて、よりよい条件でデータが補正できる場合もあるとされます。一方で、陽性細胞数が少なすぎる場合には、コンペンセーションが不可能になる場合もあります(例えばEnrichしていない白血球から、Treg(制御性T細胞)などまれな細胞集団を染色したくてFOXP3を染色する場合など)。その場合には、事前に細胞をMACSやEasysepでエンリッチする方法もありますが、通常は細胞が貴重なのでビーズを使う場合が多いと思います
Compensation beadsとは、
- Compensation controlを細胞を使わずに準備する方法です
- 蛍光陰性のビーズと、蛍光抗体を吸着するビーズの2種類を混ぜて使います
- 使用する蛍光抗体の動物の種類の確認が必要です
- アミン系の死細胞染色色素に対応したビーズもあります
ビーズに抗マウス・ラット・ウサギ etc.抗体が結合された製品です(製品により対応動物種が違う)。Compensation beadsと普段の染色に使う抗体をしばらく反応させるとビーズが抗体を介して蛍光色素と結合されて、Compensation controlとして使うことができます。利点は細胞を節約できることです。欠点は細胞を使用した場合とバックグラウンド(自家蛍光)が異なるので、自分の検査・実験系でワークするか検討が必要です
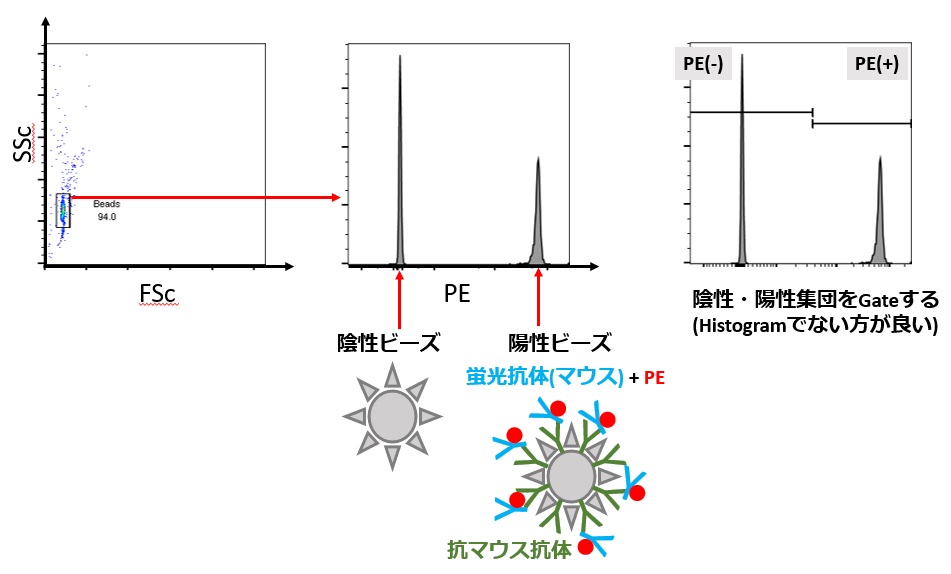
ナカノが普段使っているのは以下のような製品です。1滴ずつ使うのが勿体ない場合は、まとめて1.5mLのチューブに滴下してピペットでFACSチューブに分注するといいです
マウス・ラット・ハムスター・ウサギ・ヒトに対応:https://www.thermofisher.com/order/catalog/product/01-3333-41
アミン系の死細胞染色色素は、穴の空いた死細胞内のタンパク質と結合して生きている細胞と見分ける色素です。この色素のCompensation controlを作ることに特化したビーズも販売されいています。詳細は死細胞の除去に関する記事をご覧ください

コンペンセーションで大事な4つの原則は、
- 必ず細胞サンプルと同じ蛍光色素を使うこと
- 陽性と陰性のControlをマッチさせること
- 重染色の検体と同じかそれ以上の蛍光強度にすること
- 十分な量のサンプルをとること
です。順番に解説します
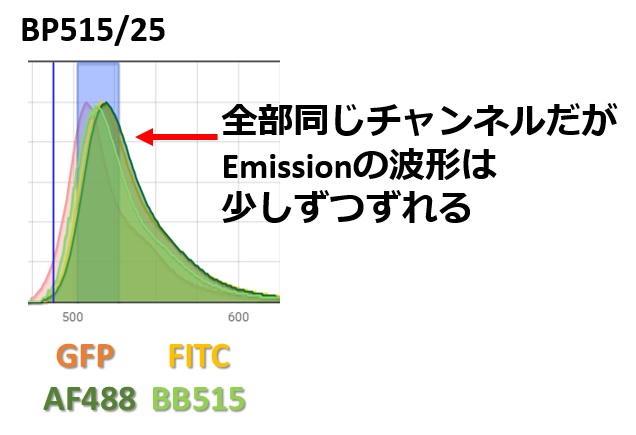
必ず細胞サンプルと同じ蛍光色素を使うこととは、
- FITC≠GFP≠AlexaFluor488≠Brilliant Bright 515
例えば、FITC・GFP・AlexaFluor488・Brilliant Bright 515などの蛍光色素は同じチャンネルでデータを採取されることが多いですが、同じ蛍光特性を持つわけではないので重染色でFITCを使うならCompensation controlも必ずFITCを使うという意味です。FITCやPEなど安定した蛍光色素の場合、ロットが違ったり別種の抗体を使っても大丈夫な場合もあります。
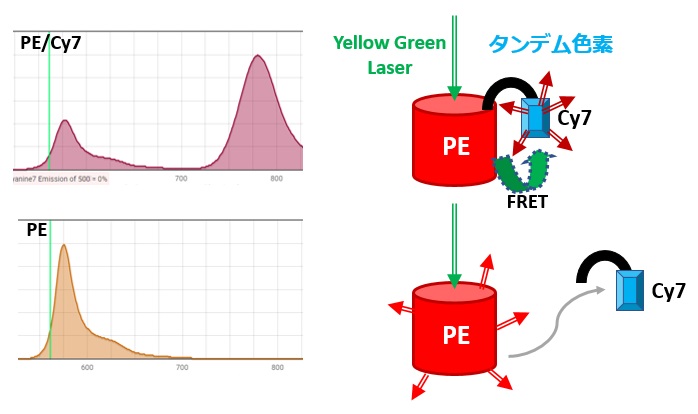
ただ、PE-Cy7などのタンデム色素といわれる不安定な色素は、ロット間だったり保存状況だったりで蛍光特性がかわります。必ず重染色と同じ抗体を使ってCompensation controlを準備する必要があります
タンデム色素についての詳細は、次の記事をご覧ください

陽性と陰性のControlをマッチさせることというのは、
- 陽性コントロールがビーズなら、陰性コントロールもビーズ
- 陽性コントロールがリンパ球なら、陰性コントロールもリンパ球
- 陽性コントロールが大きいセルラインなら、陰性コントロールも同じ細胞
例えば染色陰性のコントロールに細胞を使っている場合、染色陽性のコントロールにも同じ種類の細胞を使うということを意味します。染色陰性のコントロールがビーズなら、染色陽性のコントロールも同種のビーズを使う必要があります。これは主に自家蛍光の違いを補正することが目的です
染色とサイトメーターでの測定を別の日に行う場合、固定する場合があると思います。その場合、Compensation controlも同様の固定・Washを行う必要があります
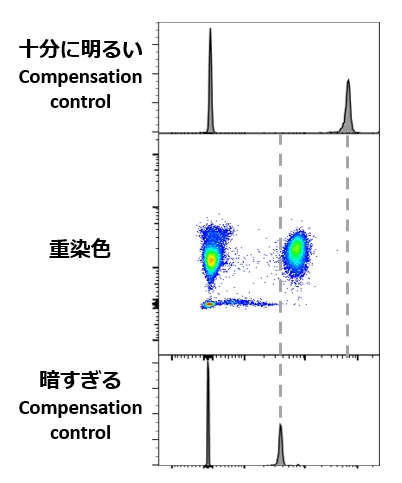
重染色の検体と同じかそれ以上の蛍光強度にすることというのは、
Compensation controlよりも多重染色の検体が明るい場合、コンペンセーションの補正が不十分になる危険性があると考えられているからです
十分な量のサンプルをとることとは、
サンプル量は状況によって考え方が異なる部分ですが、一般的に陽性・陰性それぞれ数千~数万イベントが良いとされています。細胞のほうがばらつきが大きいので一般にビーズより多くサンプルを採取することが推奨されています
毎回Compensation controlを準備するべきか
- 答えは「可能な限り毎回」「タンデム色素では特に大事」
よくある質問ですが、その日の染色条件・フルイディクス・レーザーの状態によってデータは微妙に異なるはずです。特にタンデム色素は不安定で、例えばPE/Cy7のPEとCy7が分解するとPEが陽性のように見える場合があります。毎回単染色の検体を持っておくことで、蛍光色素の状態を継時的に記録しておくことが出来ます。3Dナカノは手間を承知で、毎回単染色の検体を準備することをオススメします
まとめ:
さて、前編ではコンペンセーションの検体準備までの話をしました。後編ではコンペンセーションの理屈と、実際の適用の仕方についてお話をしたいと思います。読んでも不明な点は質問をお寄せください。自信を持って正しい結果を出せるように頑張っていきましょう!







コメント